Akut Miyeloid Lösemi (AML) - Kısa Bilgiler
Akut miyeloid lösemi (AML) kan yapıcı sistemin kötü huylu bir hastalığıdır. Aşağıdaki yazıda hastalık tablosu, olası hastalık sebepleri ve bulguları, hastalığın seyri, tanısı, tedavi planlaması, tedavisi, tedavi iyileştirme çalışmaları, rehabilitasyonu, tedavi sonrası izlemi ve hastalığın prognozu hakkında detaylı bilgi bulacaksınız.
yazar: Maria Yiallouros, editör: Maria Yiallouros, Yayın İzni: Prof. Dr. med. Ursula Creutzig (deutsch), Dr. med Ebru Saribeyoglu (türkisch), türk tercüman: Dr. med. Ebru Saribeyoglu, Sait Kont, Last modification: 2024/04/16 https://kinderkrebsinfo.de/doi/e77137
Table of contents
Hastalık tablosu
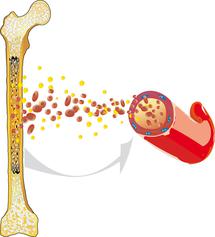
Akut miyeloid lösemi (AML), aynı zamanda akut lenfoblastik olmayan lösemi (kan kanseri) olarak da tanımlanır, kan ve kan yapıcı sistemin kötü huylu bir hastalığıdır. Hastalık kanın yapıldığı kemik iliği içinde ortaya çıkar ve genel olarak olgun olmayan beyaz kan hücrelerinin (lökositler, akyuvarlar) gereğinden fazla üretilmesi sonucu ortaya çıkar.
Normal olarak tüm kan hücreleri uyumlu bir denge içerisinde çoğalırlar ve kendilerini yenilerler. Bu esnada karmaşık bir olgunlaşma sürecinden geçerler. AML hastalığında bu süreç kontrol dışı kalmaktadır: Akyuvar da denilen lökositler işlev gören hücre olarak gelişmemekte, bunun aksine hızlı ve kontrol dışı olarak çoğalmaktadırlar ve buna bağlı olarak artan şekilde sağlıklı kan oluşumunu devre dışı bırakmaktadırlar. Bu nedenle sağlıklı akyuvarlar (lökositler), alyuvarlar (eritrositler) ve kan pulcukları (trombositler) artık gerekli miktarda oluşturulamazlar.
Bunun sonucunda kansızlık (anemi), enfeksiyon ve artan kanama eğilimi görülebilir ve aynı zamanda akut lösemi hastalığının ilk başlangıç belirtileri de ortaya çıkar. AML hastalığı daha başlangıcından itibaren vücudun belirli bir bölgesinde sınırlı olmadığı için, aksine kemik iliğinden hareketle kana, lenfatik dokuya [lenfatik sistem] ve tüm diğer organlara ve dolayısıyla vücudun tüm organ sistemine yayılabilir. İşte bu sebepten bu hastalık, tüm lösemilerde de olduğu gibi, kötü huylu bir sistemik hastalık olarak tanımlanır.
AML hastalığı oldukça hızlı seyreder. Tedavi edilmezse, lösemi hücrelerinin yayılmasıyla ve bu vücudun çeşitli organlarında hasar oluşturması nedeniyle diğer ağır hastalık tabloları ortaya çıkar. Bu ciddi hastalıklar tedavi edilmezse, hasta bir kaç hafta veya ay içerisinde kaybedilir.
Görülme sıklığı
Akut miyeloid lösemi (AML), akut lenfoblastik lösemi (ALL) hastalığından sonra çocuklarda ve gençlerde ikinci sıklıkta görülen lösemi (kan kanseri) türüdür, çocukluk çağı lösemilerinin yaklaşık %20’sini oluşturur. Çocukluk ve gençlik yaşlarında görülen tüm kötü huylu hastalıklar içerisindeki oranı yaklaşık %4 civarındadır. Mainz kentindeki çocuk kanserleri veri bankasının verilerine göre Almanya’da her sene 0-17 yaş arasındaki 90 çocuk ve gençte akut miyeloid lösemi hastalığı tespit edilmektedir. Yıllık olarak yeni tanı konan hasta sayısı (18 yaşın altındakiler) 100 kişi civarındadır.
AML hastalığı her yaşta ortaya çıkabilir ve en sık olarak da ilerlemiş yetişkinlik yaşlarında ortaya çıkar. Bebekler ve ilk iki yaş içerisindeki çocuklar, çocuk ve genç yaş grubundaki hastalar arasında hastalığın en sık görüldüğü gruptur. Ortalama hastalığa yakalanma yaşı yaklaşık yedidir. Erkek çocukların hastalığa yakalanma oranı, kız çocuklarına oranla biraz daha fazladır (erkek/kız oranı 1,1:1).
Akut miyeloid lösemi türleri
AML hastalığı, olgun olmayan miyeloid hücre cinsi hücrelerin kötü huylu değişime uğraması (kontrolden çıkması) sonucunda ortaya çıkar. Burada adı geçenler, kan oluşumundaki kök hücreleri denilen hücrelerdir (kan kök hücreleri). Bunlardan gelişme sürecinde kök hücre türüne göre belirli beyaz kan hücreleri (granulositler, monositler), kırmızı kan hücreleri (eritrositler, alyuvarlar) veya kan pulcukları (trombositler) meydana gelir.
AML hastalığında genel kural olarak granulosit ön hücresinde (miyeloblast) dejenerasyon yani kontrolden çıkma söz konusudur. Ancak aynı zamanda diğer miyeloid hücrelerde de, yani monosit kök hücrelerinde, kırmızı kan hücrelerinde, kan pulcuklarında (trombositlerde) veya bunların ortak ön hücrelerinde de dejenerasyon meydana gelebilir. Kötü huylu değişim çeşitli hücre tiplerini etkisi altına alabildiğinden ve değişik olgunluk aşamasında belirebildiğinden, çeşitli AML türleri (örneğin miyeloblastik lösemi, monoblastik lösemi, eritroblastik lösemi, megakaryositik lösemi ve çeşitli karışık türleri) mevcuttur. Kısa bir süre öncesine kadar lösemi hücrelerinin geliş kaynaklarına göre sekiz AML ana türü ayırt edilmekteydi. Bugün bu sınıflandırma dejenere olan hücrelerin gösterdiği genetik değişime göre yapılmaktadır.
Mikroskop altında görülebilen lösemi hücrelerinin (morfolojik) yapısına bağlı olarak, sekiz farklı AML formu ayırt edilir; bunlar geçmişte AML'nin sınıflandırılması (klasifikasyonu) için önemliydi. Günümüzde sınıflandırma, dejenere olmuş hücrelerin morfolojik özellikleri yanında sitogenetik ve moleküler genetik özelliklerine dayanmaktadır.
Önemli bilgi: Burada çeşitli AML şekilleri yani türleri olduğunu bilmek önemlidir, çünkü bunlar hastalık seyri ve iyileşme beklentisi (prognoz) bakımından, birbirlerinden önemli farklılıklar gösterirler. Tedavi seçiminde bu farklılıklar dikkate alınır.
Sebepleri
Akut miyeloid lösemi hastalığının (AML) oluşum nedenleri pek bilinmemektedir. Gerçi hastalığın olgun olmayan miyeloid hücre denilen türden hücrelerin kötü huylu değişiminden meydana geldiği ve dejenerasyonun hücrenin genetik yapısından kaynaklandığı bilinmektedir. Ancak vakaların çoğunluğunda genetik değişimlerin neden oluştuğu ve bunun neden bazı çocuklarda hastalanmaya neden olup bazılarında olmadığı açıklanamamaktadır. Büyük olasılıkla AML meydana gelmeden önce genetik faktörlerin ve diğer etkenlerin birlikte etki etmeleri gerekmektedir.
Belirli genetik veya sonradan oluşan immun sistemi bozuklukları (bağışıklık sistemi bozukluğu) veya belirli kromozom değişiklikleri olan çocuk ve gençlerin AML hastalığına yakalanmada daha fazla risk taşıdıkları bilinmektedir. AML gelişimini kolaylaştıran önceden var olan kalıtsal koşullar örneğin Down sendromu, Fanconi anemisi, Bloom sendromu, nörofibromatozisve ailesel monozomi 7’dir. Bu klinik tablolar kanser gelişimine yatkınlıkla ilişkili olduğundan kansere yatkınlık yaratan sendromlar olarak da adlandırılırlar. Bunların dışında radyoaktif ışınlar [radyoaktif ışınlar] ve röntgen ışınları, belirli kimyasal maddeler ve ilaçlar, ebeveynlerin sigara ve alkol kullanmaları ve büyük olasılıkla virüsler löseminin ortaya çıkmasında rol oynayabilirler. Ancak hastaların çoğunluğunda hastalığı tetikleyen faktörler aslında bilinmemektedir.
Hastalık belirtileri
Akut miyeloid lösemi (AML) ile ilişkili semptomlar (belirtiler) genellikle birkaç hafta içerisinde ortaya çıkarlar. Bunların nedenleri kötü huylu hücrelerin kemik iliği ve vücudun diğer organ ve dokularında yayılmasıdır. Lösemi hücrelerinin kemik iliği içerisinde engellenemeyen çoğalmaları, normal kan hücrelerinin oluşumunu artan şekilde olumsuz olarak etkilemektedir.
AML hastalığına yakalanan çocuklar ve gençlerde bundan dolayı genellikle önce genel hastalık belirtileri olan halsizlik, oynama isteksizliği ve solukluk (kansızlık, anemi) ortaya çıkar. Bunun nedeni, görevleri vücut hücrelerine oksijen taşımak olan alyuvarların (kırmızı kan hücrelerinin, eritrositlerin) azlığıdır. Bunun yanısıra işlev gören akyuvarların (beyaz kan hücrelerinin, lökositlerin) eksikliğinden dolayı (örneğin lenfositler ve granulositler hastalık yapan mikroorganizmalara karşı yeterli mücadele yapılamamakta ve ateşlenme ile kendini gösteren enfeksiyonlar meydana gelmektedir.Hızlı bir kan pıhtılaşması sürecinde etkili olan trombositlerin eksikliği ise, deri ve mukoza kanamalarına yol açabilir.
Lösemi hücrelerinin vücutta çoğunluğu ele geçirmesi, kan yapısındaki değişiklik haricinde organlarda da rahatsızlıklara yol açmaktadır: Lösemi hücrelerinin kemik boşluklarında, kemik iliğinde yerleşmesi özellikle el ve ayaklarda kemik ağrılarına neden olabilir. Bu ağrılar öyle belirginleşebilirler ki, küçük çocuklar yürümek istemeyip kucakta taşınmak zorunda kalabilirler. Kötü huylu hücreler ayrıca karaciğer, dalak ve lenf düğümleri (lenf bezleri) içine yerleşerek buraların şişmesine (büyümesine) sebep olabilirler. Organlardaki büyümenin bölgesine göre örneğin karın ağrısı gibi rahatsızlıklar ortaya çıkabilir. Kötü huylu hücrelerin yerleşemediği hiçbir organ veya bölge yoktur. AML hastalarında beyin zarları da olumsuz etkilenebilir. Bunun sonucunda baş ağrısı, yüz felci, görme bozuklukları ve/veya kusma ortaya çıkabilir. Ayrıca deri ve mukozalarda tümör oluşumu görülebilir.
En önemli semptomlar aşağıda bir özet halinde verilmektedir:
Çok sık görülenler (hastaların % 60 ından fazlasında mevcut olan bulgular):
- Yorgunluk, genel halsizlik, isteksizlik ve kendini hasta hissetme
- Alyuvarların eksikliği nedeniyle cilt solukluğu (anemi)
- Ateş ve/veya akyuvarların eksikliği nedeniyle artan enfeksiyon yatkınlığı (nötropeni)
- Karın ağrısı ve iştahsızlık (dalak ve/veya karaciğer büyümesi nedeniyle)
Kısmen sık görülenler (hastaların yaklaşık % 20 ile % 60 kadarında mevcut olan bulgular)
- Sebepsiz olarak veya ancak pek hafif bir dış etkiyle kanama eğilimi, örneğin zorlukla durdurulabilen burun ve/veya diş eti kanamaları, mor lekeler ve ciltte ufak nokta şeklinde morumsu yüzeysel kanamalar (peteşi), ender olarak beyin kanamaları
- Lenf düğümlerinde şişlik, örneğin boyunda, koltuk altlarında veya kasıklarda
- Kemik ve eklem ağrıları
Ender görülenler (hastaların % 20’sinden azında mevcut olan bulgular)
- Baş ağrısı, görme bozukluğu, kusma, beyin siniri felci (merkezi sinir sisteminin) de etkilenmesi sebebiyle
- Nefes darlığı (hiperlökositoz durumunda)
- Cilt değişiklikleri ve kloroma (miyeloblastom veya miyelosarkom): Ciltte, lenf düğümlerinde veya kemiklerde, bazen gözlerin etrafında, kısmen mavimsi yeşilimsi renkte tümör şeklinde lösemi hücrelerinin toplanması
- Diş etlerinde büyüme ve şişlik oluşması (gingival hiperplazi)
- Testislerin birinde veya her ikisinde büyüme
Önemli bilgi: AML hastalık belirtilerinin şiddeti kişiden kişiye değişiklik gösterebilir. Ancak yukarda belirtilen bir veya daha fazla hastalık belirtisinin ortaya çıkması, illa ki lösemi hastalığının mevcut olduğu anlamına gelmez. Bu semptoların (belirtilerin) birçoğu lösemi ile hiçbir ilgisi olmayan zararsız hastalıklarda da ortaya çıkabilir. Ancak bu tip şikayetlerde mümkün olan en kısa sürede bir doktora başvurmak ve bunların nedenlerini açıklığa kavuşturmak önerilir. Gerçekten akut lösemi saptanması durumunda mümkün olan en kısa sürede tedaviye başlanması gerekir.
Tanı
Doktor veya çocuk doktoru muayene ettiği çocuğun hastalık geçmişinde (anamnezi) ve fiziksel muayene kapsamında akut lösemi olabileceğine dair veriler elde ederse, önce geniş kapsamlı bir kan tetkiki yaptıracaktır. Kan sayımı kan tablosu içindeki bazı değişiklikler lösemi şüphesini arttırırsa, teşhisin yani tanının güvencesi açısından kemik iliği (kemik iliği ponksiyonu, kemik iliği aspirasyonu) örneği alınması gerekli olacaktır. Bu amaçla ve daha sonra yapılacak olası muayeneler için doktor, hastasını çocuklar ve gençlerde kanser ve kan hastalıkları alanında uzmanlaşmış bir hastaneye sevk edecektir (pediatrik onkoloji ve hematoloji kliniği).
Kan ve kemik iliği muayenesi
Kan ve kemik iliği incelemeleri hastanın lösemi hastalığına yakalanıp yakalanmadığını, yakalandı ise löseminin hangi tipinin söz konusu olduğu hakkında detaylı ve tam bir bilgi edinilmesini sağlayacaktır. Bu kapsamda (sitomorfolojik) immünolojik ve genetik laboratuar yöntemleri yardımıyla hem AML hastalığını diğer lösemi türlerinden (örneğin akut lenfoblastik lösemi, ALL) ayırabilmek, hem de AML hastalık tablosu içinde çeşitli alt grupları tanımak da mümkündür. Bu durum hedefli bir tedavi planlanması için önemli bir ön şarttır, çünkü bugün için özellikle şu gerçek bilinmektedir: Değişik AML şekilleri birbirlerinden yalnız hücresel ve moleküler düzeyde farklı olmakla kalmamakta, aynı zamanda hastalık seyirleri, iyileşme beklentileri (prognoz) ve tedavi edilebilirlik bakımından da farklılık göstermektedirler.
Hastalığın yaygınlığının araştırılması için yapılması gereken tetkikler
AML hastalığının tanısı konduğunda tedavi planlaması için kemik iliği dışında vücudun başka organlarının da örneğin beyin, karaciğer, dalak, lenf düğümleri, deri veya kemiklerin lösemi hücreleri tarafından istila edilip edilmediğinin bilinmesi çok önemlidir. Bu konuda ultrasonografi tetkiki, röntgen tetkiki, manyetik rezonans tomografi (MR) ve/veya bilgisayarli tomografi (BT) gibi çeşitli yöntemler bilgi verebilir. Merkezi sinir sisteminin (beyin ve omurilik) hastalık tarafından tutulup tutulmadığını tespit edebilmek için, omurilik kanalından örnek alınarak (lomber ponksiyon ile beyin omurilik sıvısı - BOS) incelenir.
Tedavi öncesinde yapılması gereken tetkikler
Tedaviye ön hazırlık amacıyla ayrıca kalp fonksiyonlarının kontrolü elektrokardiyografi [EKG] ve ekokardiyografi [ECHO]) ve beyin fonksiyonlarının kontrolü (elektroensefalografi, EEG) yapılır. Bu tip başlangıç bulgularının bilinmesi tedavi sırasında ortaya çıkabilecek değişikliklerin daha iyi değerlendirilebilmesini sağlayacaktır. Geniş kapsamlı laboratuvar tetkikleri ile hastanın genel sağlık durumu kontrol edilebildiği gibi bunun yanı sıra lösemi sebebiyle bazı organlarda (örneğin böbrekler ve karaciğer) fonksiyon bozukluğu olup olmadığı veya metabolik bozukluk olup olmadığı tespit edilebilir. Bu veriler tedaviden önce veya tedavi sırasında özellikle dikkate alınmalıdır. Muhtemelen yapılması gerekebilecek kan nakli (kan transfüzyonu) için hastanın kan grubu da belirlenmelidir.
Önemli bilgi: Yukarıda sayılan bütün tetkiklerin her hastaya yapılması gerekmeyebilir. Öte yandan burada sayılmayan diğer başka tetkiklerin de yapılması gerekli olabilir. Tedavinin planlanması için yetkili tedavi ekibiniz, hangi tanısal tetkiklerin çocuğunuza uygulanmasının gerektiği konusunda sizi bilgilendirecektir.
Tedavi planı
Tanı kesinleştikten sonra tedavi planlanır. Tedaviyi planlayan ekip mümkün olduğunca kişiye özgü yani hastaya göre uyarlanmış (risk adaptasyonu yapılmış) bir tedavinin gerçekleştirilmesi amacıyla hastadaki prognoz durumunu (tedaviye yanıtı) etkileyen belirli faktörleri (risk ve prognoz faktörleri) dikkate alır.
Önemli prognostik faktörler, bir yandan AML'nin alt tipidir ("Akut miyeloid lösemi türleri" bölümüne bakınız), diğer yandan da hastalığın vücutta yayılma derecesi ve AML'nin kemoterapiye yanıtıdır. Tümör tipinin tam olarak bilinmesi, tedavi ekibine, tümör hücrelerinin kemoterapiye ne kadar duyarlı olduğu ve nüks riskini mümkün olduğunca düşük tutmak için hastanın hangi tedavi planını izlemesi gerektiği hakkında ipuçları verir. Hastalığın yayılım derecesi ve tedaviye yanıt verme oranı, kemoterapiye ek olarak başka tedavi yöntemlerinin (örn. iyileşme şansını artırmak için kafatasının ışınlanması (radyoterapi) veya yüksek doz kemoterapiyi takiben kök hücre nakli yapılması) gerekli olup olmadığına ilişkin kararı etkiler.
Her hasta için mümkün olan en iyi tedavi sonucunu elde etmek amacıyla tüm risk faktörleri tedavi planlamasında göz önünde tutulur. Bu nedenle ilgili hastalık durumu, hastanın hangi tedavi grubuna alınacağı ve hangi tedavi planına göre tedavi edileceği konusunda belirleyicidir. Şu anda üç risk grubu ayırt edilmektedir: standart risk grubu, orta risk grubu ve yüksek risk grubu.
Tedavi
Akut miyeloid lösemi (AML) şüphesinin bulunması veya doğrulanması durumunda hastanın en kısa sürede çocuk onkoloji servisinde tedavi altına alınması gerekmektedir. Buradaki yetkin ekip (doktorlar, hastabakıcılar) kanser hastası çocukların tedavisi konusunda uzmanlaşmışlardır ve modern tedavi yöntemlerini bilmektedirler. Çocuk hematologları ve onkologları birbirleri ile uzmanlar grubu olarak sürekli temas halinde bulunurlar. Bu çerçevede hastalarını birlikte geliştirdikleri ve sürekli olarak iyileştirdikleri tedavi planlarına (protokollerine) göre tedavi ederler. Tedavinin hedefi mümkün olduğunca yüksek sayıda hastayı iyileştirmek ve bunun yanı sıra mümkün olduğunca düşük oranda yan etkilere ve ardıl sonuçlara (geç yan etkilere) ulaşabilmektir.
Tedavi yöntemleri
Akut miyeloid lösemi (AML) hastalarının tedavisinin merkezinde, yoğun bir kemoterapi (ilaçla tedavi) vardır. Kemoterapi adı altında hücre büyümesini engelleyen ilaçların (sitostatik ilaçlar) kullanılması anlaşılır. Tek bir ilaç tüm lösemi hücrelerini öldürmekte yetersiz kalacağı için sıklıkla değişik etki mekanizmaları olan sitotoksik ilaçlar birlikte kullanılır (polikemoterapi, kombinasyon tedavisi). Bu şekilde kötü huylu hücrelerin çok büyük bölümüne etki gösterilmesi hedeflenir.
Down sendromu ve APL’de tedavi farklılıkları vardır: Diğer AML hastalarına göre Down sendromlu AML hastalarında daha az yoğun bir tedavi yeterli olmaktadır. AML’nin özel bir çeşidi olan promyelositer lösemide (APL) neredeyse tüm kemoterapi ilaçları kullanımdan çıkarılır ve kemoterapötik ilaçlar yerine başka ilaçlar kullanılır.
Çok az hastada kemoterapiye ek olarak merkezi sinir sistemi ışınlaması (kafatası ışınlaması, beyin radyoterapisi) gerekir. Bu tedavi örneğin tanı sırasında merkezi sinir sisteminde lösemi hücreleri saptanmışsa uygulanır. Tedaviye başından itibaren yanıt vermeyen veya hastalığı yeniden tekrarlayan (nükseden) hastalarda yüksek doz kemoterapiyi takiben kök hücre nakli (kemik iliği nakli - KİT) başka bir tedavi seçeneğidir.
Tedavinin öncelikli hedefi vücut içerisindeki lösemi hücrelerini mümkün olduğunca tamamen yok etmek ve kemik iliğinin kan oluşturucu organ olarak görevini yeniden yerine getirmeye başlamasını sağlamaktır. Bu süreç zarfında komplikasyonların (istenmeyen yan etkilerin) ortaya çıkmasını engellemeye yarayan tedaviyi destekleyici önlemler de uygulanmaktadır. Bu destek tedavisi (supportif tedavi) AML hastalarında tedavinin önemli bir bölümünü oluşturmaktadır.
Önemli bilgi: Uygulanacak kemoterapinin yoğunluğu, tedavi süresi, ek olarak ışın tedavisi (radyoterapi) veya kök hücre nakli gerekliliği ve hastalığın prognozu (başarısı), hastanın hangi AML alt grubuna yakalandığına, lösemi hücrelerinin vücuda ne derecede yayıldığına ve löseminin tedaviye verdiği yanıta göre değişiklik gösterir. Bu hususlar göz önüne alınarak hastanın hangi tedavi grubuna alınacağına ve hangi tedavi protokolü uyarınca tedavi edileceğine karar verilir (bakınız tedavi planlama).
Tedavi süreci
Prensip olarak (yukarıda belirtilmiş olan Down sendromlu ve APL alt tipindeki AML hastaları hariç) kemoterapi değişik sürelerde, değişik kombinasyonlarda verilen ve değişik hedefleri olan tedavi fazlarından oluşur. Önemli tedavi basamakları aşağıdadır:
- İndüksiyon (saldırı-hücum tedavisi): Bu tedavi özellikle yoğun bir kemoterapi uygulamasından oluşur ve kısa bir süre içerisinde lösemi hücrelerinin büyük çoğunluğunu yok etmeye, yani remisyon oluşmasına yöneliktir. İndüksiyon tedavisi, iki kemoterapi seansından ibarettir ve dinlenme devreleri dahil yaklaşık iki ay sürer.
- Konsolidasyon ve yoğunlaştırma tedavisi: Bu tedavi, indüksiyon tedavisinin sonrasında başlar ve yine kısmen diğer ilaç kombinasyonları ve yüksek ilaç dozları ile desteklenen iki veya üç yoğun kemoterapi seansından oluşur. Bu tedavinin hedefi, vücutta hala kalmış olan lösemi hücrelerini öldürmek ve hastalığın yenileme olasılığını en aza indirgemektir. Yoğunlaştırma tedavisi yaklaşık üç veya dört ay sürer.
- Merkezi sinir sistemi (MSS) tedavisi: Bu yöntem merkezi sinir sistemi (MSS) için önleyici (profilaktik) veya tedavi edici amaçla kullanılır. Bu tedaviyle beyin ve omurilikiçinde lösemi hücrelerinin yerleşmesi veya yayılmaya devam etmesi önlenmeye çalışılır. MSS tedavisi genellikle omurilik kanalına birçok ilaç verilmesi ile gerçekleştirilir (intratekal kemoterapi uygulaması, bel iğnesi). Merkezi sinir sisteminde lösemi hücrelerinin bulunması durumunda ilaçla tedaviye ek olarak beyine (kafatası) radyoterapi yani ışınlama tedavisi de uygulanır.
- İdame tedavisi veya sürekli tedavi: Bu yöntem daha hafif bir kemoterapiden oluşur ve bir yıl süreli olarak genellikle ayakta yani hastaneye yatmadan (ayaktan) uygulanır. Tedavinin hedefi, uzun bir tedavi süresi ile yoğun tedaviye rağmen ölmemiş olan lösemi hücrelerini olanaklar ölçüsünde yok etmektir. Önemli not: İdame tedavisi son zamanlarda tedavinin bir parçası olmaktan çıkarılmıştır.
Bazı hastalara (tanı sırasında kanda yüksek oranda lösemi hücresi bulunması veya organların ağır şekilde lösemi etkisinde bulunması durumunda) asıl uygulanacak tedavi öncesinde ön tedavi diye adlandırılan bir tedavi uygulanır. Yaklaşık bir haftalık bu ön tedavinin hedefi, hücre parçalanma sendromu veya tümör lizis sendromu gibi komplikasyonlardan kaçınabilmek için, lösemi hücrelerinin sayısını adım adım, vücudu olabildiğince yormadan azaltabilmektir.
Tedavinin toplam süresi: Idame veya devam tedavisi olmaksızın yaklaşık altı ay (kök hücre nakli gerekmediği ve nüks olmadığı sürece). Tedavinin bu altı aylık yoğun bölümü birçok kez hastanede yatmayı gerektirse de kemoterapi uygulamaları arasındaki dinlenme araları, herhangi bir sorun (ateş veya enfeksiyon gibi) ortaya çıkmazsa evde gerçekleştirilebilir. Yakın zamana kadar tedavinin bir parçası olan yaklaşık bir yıllık daha hafif uzun süreli tedavi sırasında hasta, gündüz kliniğine veya polikliniğe düzenli ziyaretler dışında evde kalabilmekteydi.
AML hastalığının özel bir alt türünün görüldüğü Down-Sendromlu hastalar için ve promiyelositik lösemi hastaları için özel tedavi kuralları geçerlidir.
Tedaviyi iyileştirme araştırmaları ve kayıt
Almanya’da akut miyeloid lösemi (AML) hastası çocuk ve gençlerin hemen hepsi tedavi iyileştirme araştırmaları (tedavi protokolleri, çalışmaları) çerçevesinde tedavi edilirler. Burada söz konusu olan klinik araştırmalardır. Araştırmaların hedefi, hastaları en güncel bilgiler ışığında tedavi etmek ve aynı zamanda tedavi imkanlarını daha iyileştirmek ve geliştirmektir.
Hastalık tanısı konduğu anda devam etmekte olan bir tedavi iyileştirme çalışması yoksa veya hasta bir çalışmaya kabul edilmek için gerekli ön şartlara sahip değilse (veri tabanına) kayıt sistemine kayıt edilir. Bu durumda tedavi genellikle tedavi merkezinin önerileri doğrultusunda gerçekleştirilir. Böylece hasta o an için mevcut olan en optimal (uygun) tedavi seçeneği ile tedavi edilmiş olur.
Halen Almanya’da AML hastası çocuk ve gençlerin tedavisi için genellikle uluslararası katılımcılarla beraberce yürütülen aşağıda belirtilen tedavi araştırmaları (protokolleri, çalışmaları) ve kayıt sistemi (veri tabanı) kullanılmaktadır.
- AIEOP-BFM-AML 2020 çalışması: AML'li çocuklar ve ergenler için uluslararası tedavi iyileştirme çalışması AIEOP-BFM-AML 2020 Şubat 2023'ün sonundan beri yürütülmektedir. Çalışmaya ilk kez AML hastalığı olan 18 yaşından küçük hastalar veya AML nüksü olan 21 yaşından küçük hastalar katılabilir. Bu çalışmaya akut promyelositik lösemili (APL), Down sendromlu ve/veya geçici miyeloproliferatif sendromlu (TMD) AML hastaları dahil edilmemiştir. Çalışmanın amacı yalnızca yeni veya farklı etki gösteren ilaçların yardımıyla tedavi oranlarını artırmak değil, her şeyden önce tedavinin yan etkilerini azaltmaktır. Çalışmaya Almanya'nın yanı sıra diğer Avrupa ülkelerinden de çok sayıda tedavi merkezi katılmaktadır.
- AML-BFM 2017 kayıt sistemi (veri bankası): Onsekiz yaş altındaki AML hastaları 2018 yılı başından itibaren AML-BFM 2017 veri tabanına dahil edilmektedirler (böylece AML-BFM 2012 veri tabanı kapanmış oldu). Veri tabanına sadece yani tanı alan hastalar değil, hastalığı tekrar eden hastalar veya ikincil tümör olarak AML gelişen hastalar da alınmaktadır. Akut promiyelositer lösemili (APL) hastaları ve Down sendromlu [Down sendromu] çocuk ve gençler de bu çalışmaya alınmaktadır. Ayrıca sıklıkla miyeloid lösemiye dönüşen geçici myeloprolifertif sendrom (TMD) tanısı almış yeni doğanlar da kayıt altına alınmaktadır. Veri tabanı merkezi bu şekilde tüm AML hastalarını birarada toplayarak hastalık hakkında daha detaylı bilgiler toplamayı ve bu şekilde tedaviyi iyileştirebilecek yöntemler bulmayı umut etmektedir. Hiç bir çalışmada yer almayan hastalara tedavi önerileri verilerek, bu hastaların da en uygun tedaviyi almaları sağlanmaktadır.
- ML-DS 2018 çalışması: Miyeloid lösemisi olan Down sendromlu çocuklar için Şubat 2021’den itibaren ML-DS 2018 isimli tedavi iyileştirme çalışması bulunmaktadır. Bu çalışmaya dahil olabilmek için, GATA1 mutasyonuna sahip veya GATA1 mutasyonu olmayan 6 aydan büyük, 4 yaşından küçük olmak veya GATA1 mutasyonuna sahip olup, 4 yaşından büyük ama 6 yaşından küçük olmak gerekmektedir. Çalışmanın amacı tedavi yanıtı iyi olan hastalarda tedavi yoğunluğunun azaltılıp azaltılamayacağının (böylece yan etkilerin azaltılmasının) araştırılmasıdır. Tüm Almanya’dan ve Avrupa ülkelerinden bir çok merkez bu çalışmada yer almaktadırlar.
Ek Bilgi: AIEOP-BFM-AML 2020 çalışması ve veri tabanı, Essen Üniversite Hastanesi Çocuk Hastalıkları Bölümü'ndeki çalışma merkezi tarafından denetlenmektedir (çalışma yöneticisi: Prof. Dr. med. Dirk Reinhardt). ML-DS 2018 çalışmasının yönetim merkezi, Dr. Jan-Henning Klusmann tarafından yönetilen Halle (Saale) ve Frankfurt/Main Üniversite Hastanelerinde yer almaktadır.
Tedavi başarısı
Akut miyeloid lösemi (AML) hastası çocuk ve gençlerin tedavi şansları son kırk yıl içerisindeki gelişmeler sayesinde önemli ölçüde artmıştır. Bugün uygulanan modern araştırma yöntemleri ve yoğun standart kombinasyonlu kemoterapiler yardımıyla hastaların yaklaşık %75-80 kadarı tanı konulduktan beş sene sonra halen yaşamaktadırlar (5 yıllık sağkalım oranı).
Öte yandan AML hastalarının yaklaşık %20-25 kadarının bugün için henüz tedavi edilemedikleri ortadadır. Bunun bir nedeni başarılı tedaviden sonra hastalığın nüksetmesi oranının (rezidiv, relaps, tekrar) yüksek olmasıdır. Hastalığın tekrarlama riski AML hastalarının hemen hemen üçte birinde görülmektedir. Bunun yanısıra ilk tedaviye yanıt vermeyen veya yetersiz yanıt veren hastalar da bulunmaktadır: Hastaların yaklaşık %10 kadarında hastalıksız olma durumu yani remisyon hedefine erişilememektedir. Bu durum, doktorlar tarafından tedavi başarısızlığı diye adlandırılmaktadır.
Her bir hasta için prognoz öncelikle hastanın AML'nin hangi genetik alt tipine sahip olduğuna ve hastalığın uygulanan tedaviye ne kadar iyi yanıt verdiğine bağlıdır: Lösemi hücre özellikleri olumlu olan ve tedaviye iyi yanıt veren has-talar %90'a varan iyileşme oranlarına ulaşabilirler. Olumsuz prognostik faktörleri (prognoz faktörleri) olan hastalarda ise, daha yoğun tedavi uygulanması rağmen iyileşme şansı %70'in çok altında olabilir. İlk tanı akut promiyelositik lösemili hastalarda (APL) hastalığın tekrar etme olasılığı çok düşük olduğundan 10 yıllık sağkalım %90’lardan fazladır, diğer tüm AML alt tiplerine göre en iyi prognoza sahiptirler.
Genel olarak hastalığın tekrar ettiği durumlarda, özellikle de ilk remisyonun elde edilmesinden sonraki ilk bir yıl içinde ortaya çıkan nükslerde tedavi başarısı çok düşüktür. Tedaviye başından itibaren iyi yanıt vermeyen hastalar için de aynı durum söz konusudur. Yeni bir kemoterapi (rezidiv tedavisi) ve bunu takiben uygulanacak kök hücre nakli (kemikiliği nakli) ile bu hastaların iyileşmesi hedeflenmektedir. AML nükslü hastalarda (AML ‘si tekrar eden hastalarda) tedavi başarısı (5 yıllık hastalıksız sağkalım) bugün için % 38 dolayındadır. Bugünkü tedavi iyileştirme araştırmaları çerçevesinde ve gelecekteki araştırmalar ile bu hastalar için daha iyi tedavi sonuçları elde edilmesi hedeflenmektedir.
Uyarı: Belirtilen iyileşme oranları istatistiki bilgilerdir. Bu rakamlar AML hastalarının tamamı için önemli ve geçerli bir bilgi içermektedirler. Ancak hastanın iyileşip iyileşmeyeceği istatistikî olarak önceden belirlenemez. Lösemi hastalığı, en uygun şartlardaki hastalarda veya en riskli hastalarda bile hiç beklenmedik şekilde seyredebilir.
Kaynakça 
- Stanulla M, Erdmann F, Kratz CP: Risikofaktoren für Krebserkrankungen im Kindes- und Jugendalter. Monatsschrift Kinderheilkunde 169, 30-38 2021 [DOI: 10.1007/s00112-020-01083-8]
- Rasche M, Zimmermann M, Steidel E, Alonzo T, Aplenc R, Bourquin JP, Boztug H, Cooper T, Gamis AS, Gerbing RB, Janotova I, Klusmann JH, Lehrnbecher T, Mühlegger N, Neuhoff NV, Niktoreh N, Sramkova L, Stary J, Waack K, Walter C, Creutzig U, Dworzak M, Kaspers G, Kolb EA, Reinhardt D: Survival Following Relapse in Children with Acute Myeloid Leukemia: A Report from AML-BFM and COG. Cancers 2021 May 12; 13 [PMID: 34066095]
- Erdmann F, Kaatsch P, Grabow D, Spix C: German Childhood Cancer Registry - Annual Report 2019 (1980-2018). Institute of Medical Biostatistics, Epidemiology and Informatics (IMBEI) at the University Medical Center of the Johannes Gutenberg University Mainz 2020 [URI: https://www.kinderkrebsregister.de/ typo3temp/ secure_downloads/ 42507/ 0/ 1c5976c2ab8af5b6b388149df7182582a4cd6a39/ Buch_DKKR_Jahresbericht_2019_komplett.pdf]
- Creutzig U, Dworzak M, Reinhardt D: Akute myeloische Leukämie (AML) im Kindes- und Jugendalter. Leitlinie der Gesellschaft für Pädiatrische Onkologie und Hämatologie AWMF [URI: https://www.awmf.org/ uploads/ tx_szleitlinien/ 025-031l_S1_Akute-myeloische-Leukaemie–AML–Kinder-Jugendliche_2019-09.pdf]
- Creutzig U, Dworzak M, von Neuhoff N, Rasche M, Reinhardt D: [Acute Promyelocytic Leukemia: New treatment strategies with ATRA and ATO - AML-BFM-Recommendations]. Klinische Padiatrie 2018, 230: 299 [PMID: 30399642]
- Creutzig U, Reinhardt D: Akute myeloische Leukämien, in Niemeyer CH, Eggert A (Hrsg.): Pädiatrische Hämatologie und Onkologie. Springer-Verlag GmbH Deutschland 2018 [ISBN: 3540037020]
- Uffmann M, Rasche M, Zimmermann M, von Neuhoff C, Creutzig U, Dworzak M, Scheffers L, Hasle H, Zwaan CM, Reinhardt D, Klusmann JH: Therapy reduction in patients with Down syndrome and myeloid leukemia: the international ML-DS 2006 trial. Blood 2017 Jun 22; 129: 3314 [PMID: 28400376]
- Creutzig U, Dworzak MN, Bochennek K, Faber J, Flotho C, Graf N, Kontny U, Rossig C, Schmid I, von Stackelberg A, Mueller JE, von Neuhoff C, Reinhardt D, von Neuhoff N: First experience of the AML-Berlin-Frankfurt-Münster group in pediatric patients with standard-risk acute promyelocytic leukemia treated with arsenic trioxide and all-trans retinoid acid. Pediatric blood & cancer 2017, Epub ahead of print [PMID: 28111878]
- Arber DA, Orazi A, Hasserjian R, Thiele J, Borowitz MJ, Le Beau MM, Bloomfield CD, Cazzola M, Vardiman JW: The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016 May 19; 127: 2391 [PMID: 27069254]
- Creutzig U ,Zimmermann M, Dworzak MN, Ritter J, Schellong G, Reinhardt D: Development of a curative treatment within the AML-BFM studies. Klinische Padiatrie 2013, 225 Suppl 1:S79 [PMID: 23700063]
- Rossig C, Jürgens H, Schrappe M, Moericke A, Henze G, von Stackelberg A, Reinhardt D, Burkhardt B, Woessmann W, Zimmermann M, Gadner H, Mann G, Schellong G, Mauz-Koerholz C, Dirksen U, Bielack S, Berthold F, Graf N, Rutkowski S, Calaminus G, Kaatsch P, Creutzig U: Effective childhood cancer treatment: The impact of large scale clinical trials in Germany and Austria. Pediatric blood & cancer 2013, 60: 1574 [PMID: 23737479]
- Kaspers GJ, Zimmermann M, Reinhardt D, Gibson BE, Tamminga RY, Aleinikova O, Armendariz H, Dworzak M, Ha SY, Hasle H, Hovi L, Maschan A, Bertrand Y, Leverger GG, Razzouk BI, Rizzari C, Smisek P, Smith O, Stark B, Creutzig U: Improved Outcome in Pediatric Relapsed Acute Myeloid Leukemia: Results of a Randomized Trial on Liposomal Daunorubicin by the International BFM Study Group. J Clin Oncol 2013, 31: 599 [PMID: 23319696]
- Creutzig U, van den Heuvel-Eibrink MM, Gibson B, Dworzak MN, Adachi S, de Bont E, Harbott J, Hasle H, Johnston D, Kinoshita A, Lehrnbecher T, Leverger G, Mejstrikova E, Meshinchi S, Pession A, Raimondi SC, Sung L, Stary J, Zwaan CM, Kaspers GJ, Reinhardt D, AML Committee of the International BFM Study Group: Diagnosis and management of acute myeloid leukemia in children and adolescents: recommendations from an international expert panel. Blood 2012, 120: 3187 [PMID: 22879540]
- Reinhardt D, Von Neuhoff C, Sander A, Creutzig U: [Genetic Prognostic Factors in Childhood Acute Myeloid Leukemia]. Klinische Padiatrie 2012, 224: 372 [PMID: 22821298]
- Niewerth D, Creutzig U, Bierings MB, Kaspers GJ: A review on allogeneic stem cell transplantation for newly diagnosed pediatric acute myeloid leukemia. Blood 2010, [PMID: 20538803]
- Sander A, Zimmermann M, Dworzak M, Fleischhack G, von Neuhoff C, Reinhardt D, Kaspers GJ, Creutzig U: Consequent and intensified relapse therapy improved survival in pediatric AML: results of relapse treatment in 379 patients of three consecutive AML-BFM trials. Leukemia 2010 [PMID: 20535146]
- von Neuhoff C, Reinhardt D, Sander A, Zimmermann M, Bradtke J, Betts DR, Zemanova Z, Stary J, Bourquin JP, Haas OA, Dworzak MN, Creutzig U: Prognostic Impact of Specific Chromosomal Aberrations in a Large Group of Pediatric Patients With Acute Myeloid Leukemia Treated Uniformly According to Trial AML-BFM 98. Journal of clinical oncology 2010, 28: 2682 [PMID: 20439630]
- Zwaan MC, Reinhardt D, Hitzler J, Vyas P: Acute leukemias in children with down syndrome. Pediatric clinics of North America 2008, 55: 53 [PMID: 18242315]
- Belson M, Kingsley B, Holmes A: Risk factors for acute leukemia in children: a review. Environmental health perspectives 2007, 115: 138 [PMID: 17366834]

 Akut Miyeloid Lösemi (AML) - Kısa Bilgiler (Akute myeloische Leukämie) (319KB)
Akut Miyeloid Lösemi (AML) - Kısa Bilgiler (Akute myeloische Leukämie) (319KB)