Akute lymphoblastische Leukämie (ALL) – Kurzinformation
Die akute lymphoblastische Leukämie (ALL) ist eine bösartige Erkrankung des blutbildenden Systems. In diesem Text erhalten Sie die wichtigsten Informationen zu Krankheitsbild und Krankheitsformen sowie zu Häufigkeit, möglichen Ursachen, Symptomen, Diagnose, Behandlung und Prognose der Erkrankung.
Autor: Maria Yiallouros, Freigabe: Prof. Dr. med. Günter Henze, Dr. med. Anja Möricke, PD Dr. med. Gabriele Escherich, Zuletzt geändert: 23.01.2024 https://dx.doi.org/10.1591/poh.patinfo.all.kurz
Inhaltsverzeichnis
Krankheitsbild
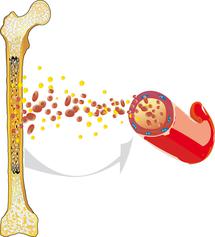
Die akute lymphoblastische Leukämie (ALL) – auch akute lymphatische Leukämie genannt – ist eine bösartige Erkrankung des blutbildenden Systems. Sie entsteht im Knochenmark, dem Ort der Blutbildung, und geht im Allgemeinen mit einer Überproduktion unreifer weißer Blutzellen einher.
Normalerweise vermehren und erneuern sich alle Blutzellen in einem harmonischen Gleichgewicht. Sie durchlaufen dabei einen komplizierten Reifungsprozess. Bei der ALL ist dieser Prozess außer Kontrolle geraten: Die weißen Blutkörperchen (Leukozyten) reifen nicht mehr zu funktionstüchtigen Zellen heran, sondern vermehren sich rasch und unkontrolliert. Sie verdrängen dadurch zunehmend die normale Blutbildung, so dass gesunde weiße Blutzellen sowie rote Blutzellen (Erythrozyten) und Blutplättchen (Thrombozyten) nicht mehr im notwendigen Umfang gebildet werden.
Blutarmut (Anämie), Infektionen und erhöhte Blutungsneigung können die Folge und zugleich auch das erste Anzeichen einer akuten Leukämie sein. Da die ALL von Anfang an nicht auf eine bestimmte Stelle im Körper begrenzt ist, sondern vom Knochenmark ausgehend das Blut, die lymphatischen Gewebe [lymphatisches System] und alle anderen Organe und somit ganze Organsysteme befallen kann, wird sie – wie alle Leukämien – auch als bösartige Systemerkrankung bezeichnet.
Die ALL nimmt einen raschen Verlauf. Erfolgt keine Behandlung, kommt es durch die Ausbreitung der Leukämiezellen und der damit einhergehenden Schädigung der Körperorgane zu schweren Erkrankungen, die unbehandelt innerhalb weniger Monate zum Tod führen.
Häufigkeit
Die akute lymphoblastische Leukämie (ALL) ist – mit einem Anteil von etwa 80 % – die häufigste Form der Leukämie bei Kindern und Jugendlichen. Sie macht (mit etwa 22 %) gut ein Fünftel aller Krebserkrankungen im Kindes- und Jugendalter aus. In Deutschland erkranken – nach Angaben der Studienzentralen – pro Jahr circa 550 bis 600 Kinder und Jugendliche unter 18 Jahren neu an einer akuten lymphoblastischen Leukämie. Die ALL kann in jedem Alter auftreten, also auch bei Erwachsenen. Am häufigsten betroffen sind jedoch Kinder zwischen 1 und 5 Jahren. Jungen erkranken etwas häufiger als Mädchen (Geschlechterverhältnis 1,3:1).
Formen der ALL
Bei der ALL findet eine bösartige Veränderung (Entartung) in einer unreifen Vorläuferzelle der Lymphozyten statt. Die Entartung kann auf verschiedenen Stufen der Zellentwicklung geschehen und verschiedene Untergruppen der Lymphozyten beziehungsweise deren Vorstufen betreffen. Aus diesem Grund gibt es verschiedene Formen der ALL. So genannte B-ALL-Formen beispielsweise gehen von Vorläuferzellen der B-Lymphozyten aus, T-ALL-Formen von Vorstufen der T-Lymphozyten. Eine Entartung auf früher Entwicklungsstufe ist durch die Vorsilbe „prä“ oder „pro“ gekennzeichnet.
Daraus ergeben sich folgende ALL-Unterformen:
- Pro-B-ALL (auch Prä-prä-B-ALL)
- Common ALL
- Prä-B-ALL
- reife B-ALL (auch B-AL)
- Pro-T-ALL
- Prä-T-ALL
- kortikale (intermediäre) T-ALL
- reife T-ALL
Die Einteilung (Klassifikation) der oben genannten ALL-Subtypen erfolgt mit Hilfe einer speziellen Untersuchungsmethode (Immunphänotypisierung). Eine noch genauere Charakterisierung der verschiedenen Typen ist anhand der genetischen Merkmale der Leukämiezellen möglich. Wichtig zu wissen ist, dass es verschiedene Formen der ALL gibt, da sich diese, was Krankheitsverlauf und Heilungsaussichten (Prognose) betrifft, zum Teil deutlich voneinander unterscheiden. Bei der Wahl der Behandlungsstrategie werden diese Unterschiede berücksichtigt.
Ursachen
Die Ursachen der akuten lymphoblastischen Leukämie (ALL) sind weitgehend unbekannt. Zwar weiß man, dass die Krankheit durch die bösartige Veränderung einer Vorläuferzelle der Lymphozyten entsteht und dass die Entartung mit Veränderungen im Erbgut der Zelle einhergeht. In den meisten Fällen bleibt jedoch unklar, warum genetische Veränderungen auftreten und warum sie bei manchen Kindern zur Erkrankung führen, bei anderen nicht.
So lässt sich zum Beispiel eine Genveränderung, die bei ALL vorkommt, bereits bei neugeborenen Kindern feststellen, die jedoch erst Jahre später an ALL erkranken. Auch erkrankt nicht jedes Kind mit einer derartigen Erbgutveränderung an ALL. Dies deutet darauf hin, dass bei der Krankheitsentstehung neben genetischen und immunologischen Faktoren auch das Immunsystem sowie äußere Einflüsse eine Rolle spielen. Vermutlich müssen verschiedene Faktoren zusammenwirken, bevor eine ALL entsteht.
Bekannt ist, dass Kinder und Jugendliche mit bestimmten ererbten oder erworbenen Immundefekten oder mit bestimmten Chromosomenveränderungen ein erhöhtes Risiko haben, an einer ALL zu erkranken. Erbliche Vorerkrankungen, die die Entwicklung einer ALL begünstigen, sind zum Beispiel das Down-Syndrom, die Fanconi-Anämie, das Bloom-Syndrom, das Louis-Bar-Syndrom und das Li-Fraumeni-Syndrom. Da diese (sehr seltenen) Krankheitsbilder mit einer Veranlagung für die Krebsentstehung einhergehen, werden sie auch als Krebsprädispositionssyndrome bezeichnet.
Darüber hinaus können auch radioaktive Strahlung und Röntgenstrahlung, bestimmte chemische Substanzen und Medikamente, Zigaretten- oder Alkoholkonsum der Eltern und möglicherweise auch Viren bei der Entstehung einer Leukämie eine Rolle spielen. Bei der Mehrheit der Patienten kennt man die krankheitsauslösenden Faktoren jedoch nicht.
Krankheitszeichen
Die Krankheitszeichen (Symptome), die mit einer akuten lymphoblastischen Leukämie (ALL) einhergehen, entwickeln sich meist innerhalb weniger Wochen. Sie sind auf die Ausbreitung der bösartigen Zellen im Knochenmark und in anderen Körperorganen und -geweben zurückzuführen. Die ungehemmte Teilung der Leukämiezellen im Knochenmark beeinträchtigt zunehmend die Produktion der normalen Blutzellen.
Kinder und Jugendliche, die an einer ALL erkrankt sind, fallen deshalb zunächst durch allgemeine Krankheitszeichen wie Mattigkeit, Spielunlust und Blässe (Anämie) auf. Diese sind bedingt durch den Mangel an roten Blutkörperchen, deren Aufgabe es ist, den Sauerstoff in die Körperzellen zu transportieren. Durch den Mangel an funktionstüchtigen weißen Blutkörperchen (zum Beispiel Lymphozyten und Granulozyten), können Krankheitserreger nicht mehr ausreichend bekämpft werden; es stellen sich Infektionen ein, die sich durch Fieber bemerkbar machen. Das Fehlen von Blutplättchen, die normalerweise für eine rasche Blutgerinnung sorgen, kann zu Haut- und Schleimhautblutungen führen.
Die Überhandnahme der Leukämiezellen im Körper führt, abgesehen von Veränderungen im Blutbild, zu Organbeschwerden: Das Wachstum der Leukämiezellen in den Hohlräumen der Knochen, im Knochenmark, kann Knochenschmerzen hervorrufen, vor allem in Armen und Beinen. Sie können so ausgeprägt sein, dass kleinere Kinder nicht mehr laufen mögen und getragen werden wollen. Die bösartigen Zellen können sich außerdem in Leber, Milz und Lymphknoten festsetzen, so dass diese Organe anschwellen und zu entsprechenden Beschwerden, zum Beispiel Bauchschmerzen, führen. Kein Organ ist grundsätzlich verschont. Bei Patienten mit einer ALL kann es auch zu einem Befall der Hirnhäute kommen. Kopfschmerzen, Gesichtslähmungen, Sehstörungen und/oder Erbrechen können die Folge sein.
Die wichtigsten Symptome sind in der folgenden Übersicht zusammengefasst:
- Müdigkeit, allgemeine Abgeschlagenheit und Lustlosigkeit, Krankheitsgefühl
- Hautblässe durch Mangel an roten Blutzellen (Anämie)
- Blutungsneigung, zum Beispiel schwer zu stillendes Nasen- und/oder Zahnfleischbluten, blaue Flecken oder kleine punktförmige Hautblutungen (Petechien)
- Fieber und/oder erhöhte Infektneigung durch Mangel an weißen Blutzellen (Neutropenie)
- Geschwollene Lymphknoten, etwa am Hals, in den Achselhöhlen oder in der Leiste
- Bauchschmerzen und Appetitlosigkeit (durch Vergrößerung von Milz und/oder Leber)
- Knochen- und Gelenkschmerzen
- Kopfschmerzen, Sehstörungen, Erbrechen, Hirnnervenlähmungen (durch Befall des Zentralnervensystems)
- Atemnot (durch Vergrößerung der Thymusdrüse oder der Lymphknoten im Brustraum)
- Vergrößerung der/eines Hoden
Gut zu wissen: Die Symptome einer ALL können individuell sehr verschieden stark ausgeprägt sein. Wichtig zu wissen ist auch, dass das Auftreten eines oder mehrerer dieser Krankheitszeichen nicht unbedingt bedeuten muss, dass eine Leukämie vorliegt. Viele dieser Symptome treten bei vergleichsweise harmlosen Erkrankungen auf, die mit Leukämie nichts zu tun haben. Bei Beschwerden ist es jedoch ratsam, so bald wie möglich einen Arzt zu konsultieren, um deren Ursache zu klären. Liegt tatsächlich eine akute Leukämie vor, muss schnellstmöglich mit der Therapie begonnen werden.
Diagnose
Findet der (Kinder-)Arzt durch Krankheitsgeschichte (Anamnese) und körperliche Untersuchung des Patienten Hinweise auf eine akute Leukämie, wird er zunächst eine umfassende Blutuntersuchung vornehmen. Wenn sich, durch bestimmte Veränderungen im Blutbild, der Verdacht auf eine Leukämie erhärtet, ist eine Entnahme von Knochenmark (Knochenmarkpunktion) zur Sicherung der Diagnose notwendig. Zu diesem Zweck und für eventuell sich anschließende Untersuchungen wird der Arzt den Patienten in ein Krankenhaus überweisen, das auf Krebs- und Bluterkrankungen bei Kindern und Jugendlichen spezialisiert ist (Klinik für pädiatrische Onkologie/Hämatologie).
Blut- und Knochenmarkuntersuchungen
Blut- und Knochenmarkuntersuchungen erlauben eine genaue Aussage darüber, ob und an welcher Art von Leukämie der Patient erkrankt ist. Die Untersuchungen beinhalten mikroskopische (zytomorphologische), immunologische und genetische Laborverfahren, die es nicht nur ermöglichen, eine ALL von anderen Leukämiearten (zum Beispiel einer AML) abzugrenzen. Es lassen sich auch innerhalb des Krankheitsbildes ALL verschiedene Unterformen unterscheiden. Dies ist eine wichtige Voraussetzung für eine gezielte Therapieplanung, denn es hat sich gezeigt, dass sich die verschiedenen ALL-Formen nicht nur auf zellulärer und molekularer Ebene voneinander unterscheiden, sondern auch deutliche Unterschiede in ihrem Krankheitsverlauf, ihren Heilungsaussichten (Prognose) und der Therapierbarkeit zeigen.
Untersuchungen zur Ausbreitung der Erkrankung
Liegt eine ALL vor, so ist es für die Behandlungsplanung auch wichtig zu wissen, ob außerhalb des Knochenmarks noch weitere Organe des Körpers – zum Beispiel Gehirn, Leber, Milz, Lymphknoten oder Knochen – von Leukämiezellen befallen sind. Auskunft darüber geben verschiedene bildgebende Verfahren wie Ultraschall- und Röntgenuntersuchung, Magnetresonanztomographie (MRT) und Computertomographie (CT). Um herauszufinden, ob auch das Zentralnervensystem (Gehirn und Rückenmark) von der Erkrankung betroffen ist, wird außerdem aus dem Nervenwasserkanal eine Probe entnommen und auf Leukämiezellen untersucht (Lumbalpunktion).
Untersuchungen vor Therapiebeginn
Behandlungsvorbereitend erfolgt ferner eine Überprüfung der Herzfunktion (Elektrokardiographie (EKG) und Echokardiographie) und der Gehirnfunktion (Elektroenzephalographie, EEG). Umfangreiche Laboruntersuchungen dienen dazu, den Allgemeinzustand des Patienten zu überprüfen und festzustellen, ob durch die Leukämie die Funktionen einzelner Organe (zum Beispiel Nieren und Leber) beeinträchtigt sind oder Stoffwechselstörungen vorliegen, die vor oder während der Behandlung besonders berücksichtigt werden müssen. Veränderungen, die möglicherweise im Laufe der Therapie auftreten, können aufgrund solcher Ausgangsbefunde besser beurteilt werden. Im Hinblick auf eventuell notwendig werdende Bluttransfusionen muss eine Bestimmung der Blutgruppe erfolgen.
Gut zu wissen: Nicht alle Untersuchungen sind bei jedem Patienten notwendig. Andererseits können eventuell Untersuchungen hinzukommen, die hier nicht erwähnt wurden. Fragen Sie Ihren behandelnden Arzt oder das Behandlungsteam, welche Untersuchungen bei Ihrem Kind geplant sind und warum die jeweilige Untersuchung erforderlich ist.
Therapieplanung
Bestätigt sich der Verdacht auf eine akute lymphoblastische Leukämie, erfolgt die Therapieplanung. Um eine möglichst individuelle, auf den Patienten zugeschnittene (risikoadaptierte) Behandlung durchführen zu können, berücksichtigt das Behandlungsteam bei der Planung bestimmte Faktoren, die die Prognose des Patienten beeinflussen (sie werden daher auch Risiko- oder Prognosefaktoren genannt).
Wichtige Prognosefaktoren sind unter anderem die immunphänotypische Unterform der ALL (siehe Kapitel „Therapieformen“), bestimmte molekulargenetische Veränderungen der Leukämiezellen, die Krankheitsausbreitung im Körper zum Diagnosezeitpunkt (initiale Leukämiezellmasse), das Ansprechen der ALL auf die Chemotherapie und das Alter des Patienten. Die genaue Kenntnis des Tumortyps gibt dem Behandlungsteam Hinweise darauf, wie sensibel die Tumorzellen auf eine Chemotherapie reagieren und wie intensiv die Patienten folglich behandelt behandelt werden müssen, um das Rückfallrisiko möglichst gering zu halten. Krankheitsausdehnung und Therapieansprechen beeinflussen die Entscheidung, ob zusätzlich zur Chemotherapie weitere Therapiemethoden (zum Beispiel eine Strahlentherapie des Schädels oder eine Hochdosis-Chemotherapie mit nachfolgender Stammzelltransplantation) zur Verbesserung der Heilungsaussichten erforderlich sind.
Alle Risikofaktoren fließen in die Behandlungsplanung ein mit dem Ziel, für jeden Patienten das jeweils bestmögliche Behandlungsergebnis zu erreichen. Die jeweilige Krankheitssituation ist somit ausschlaggebend dafür, welcher Therapiegruppe (Standardrisikogruppe, mittlerer Risikogruppe oder Hochrisikogruppe) der Patient zugeordnet wird. Weitere Informationen zur Therapieplanung finden Sie in unserem ausführlichen Patiententext hier.
Behandlung
Die Behandlung eines Patienten mit akuter lymphoblastischer Leukämie (ALL) muss schnellstmöglich in einer kinderonkologischen Behandlungseinrichtung erfolgen. Dort ist das hoch qualifizierte Fachpersonal (Ärzte, Fachpflegekräfte) auf die Behandlung krebskranker Kinder spezialisiert und mit den modernsten Therapieverfahren vertraut. Die Ärzte dieser Klinikabteilungen stehen in fachorientierten Arbeitsgruppen in ständiger, enger Verbindung miteinander und behandeln ihre Patienten nach gemeinsam entwickelten und stetig weiter verbesserten Therapieplänen. Ziel der Behandlung ist, eine hohe Heilungsrate bei möglichst geringen Nebenwirkungen und Spätfolgen zu erreichen.
Behandlungsmethoden
- Chemotherapie: Im Zentrum der Behandlung von Patienten mit akuter lymphoblastischer Leukämie (ALL) steht die Chemotherapie. Man versteht darunter eine Behandlung mit zellwachstumshemmenden Medikamenten (Zytostatika). Da ein einzelnes Medikament in der Regel nicht ausreicht, um alle Leukämiezellen zu vernichten, werden Kombinationen verschiedenartig wirkender Zytostatika eingesetzt (Polychemotherapie). Auf diese Weise soll die größtmögliche Wirkung gegen die bösartigen Zellen erzielt werden.
- Strahlentherapie: Bei manchen Patienten erfolgt zusätzlich zur Chemotherapie eine Strahlentherapie des Zentralnervensystems (Schädel-Bestrahlung). Allerdings wird eine zunehmende Reduktion der Bestrahlung angestrebt, so dass die Indikation für die Strahlentherapie derzeit sehr im Fluss ist.
- Stammzelltransplantation: In bestimmten Fällen ist eine hoch dosierte Chemotherapie (Hochdosis-Chemotherapie) mit anschließender Stammzelltransplantation notwendig.
Das Ziel der Behandlung besteht darin, die Leukämiezellen im Körper möglichst vollständig zu vernichten, so dass das Knochenmark seine Funktion als blutbildendes Organ wieder aufnehmen kann. Die Intensität und Dauer der Chemotherapie, die Notwendigkeit einer Bestrahlung des Zentralnervensystems oder einer Stammzelltransplantation sowie die Prognose der Erkrankung richten sich unter anderem danach, an welcher ALL-Unterform der Patient erkrankt ist, wie stark sich die Leukämiezellen im Körper bereits ausgebreitet haben und wie die Leukämie auf die Therapie anspricht (siehe Kapitel "Therapieplanung").
Anmerkung zur reifen B-ALL: Patienten mit reifer B-ALL (B-AL) werden nicht im Rahmen der Therapiepläne behandelt, die für die übrigen Formen der akuten lymphoblastischen Leukämie gelten. Sie erhalten eine Therapie wie Patienten mit einem reifen B-Zell Non-Hodgkin-Lymphom und sind daher in den folgenden Ausführungen nicht berücksichtigt. Informationen zu den Non-Hodgkin-Lymphomen finden Sie hier.
Behandlungsablauf
Die chemotherapeutische Behandlung eines Patienten mit ALL erfolgt grundsätzlich in mehreren Therapieabschnitten. Die verschiedenen Therapiephasen sind von unterschiedlicher Dauer und unterscheiden sich auch hinsichtlich der eingesetzten Medikamentenkombinationen sowie der Intensität und Zielsetzung der Behandlung. Innerhalb der einzelnen Therapieabschnitte werden die Patienten nach unterschiedlichen Therapieplänen (Protokollen) behandelt. Welcher Therapieplan im Einzelfall eingesetzt wird, hängt unter anderem davon ab, zu welcher Risikogruppe der Patient gehört und in welchem Therapiezweig er infolgedessen behandelt wird. Je höher das Risiko eines Krankheitsrückfalls ist, umso intensiver wird in der Regel auch die Behandlung sein.
Sofern es zu keinem Rückfall kommt, beträgt die Gesamtdauer der Behandlung etwa zwei Jahre. Sie setzt sich aus einer intensiven Therapiephase mit vielen Klinikaufenthalten (circa ein halbes Jahr) und einer eher gemäßigten, meist ambulanten Therapiephase (circa eineinhalb Jahre) zusammen.
Wichtige Therapieelemente sind:
- Vortherapie (Vorphase): In vielen ALL-Therapieprotokollen beginnt die Induktionstherapie mit einer so genannten zytoreduktiven Vorphase. Sie dient der Einleitung der Behandlung und besteht aus einer kurzen, circa einwöchigen Chemotherapie mit ein oder zwei Medikamenten. Der Zweck der Vortherapie besteht darin, die anfangs oft große Zahl der Leukämiezellen schrittweise und damit für den Organismus möglichst schonend zu reduzieren. Das ist deshalb wichtig, weil aus den abgetöteten Leukämiezellen durch den Zellabbau bestimmte Stoffwechselprodukte freigesetzt werden, die den Organismus und insbesondere die Nieren schädigen, wenn sie in großen Mengen auftreten (so genanntes Tumorlyse-Syndrom).
- Induktion: Die eigentliche Induktionstherapie besteht aus einer besonders intensiven Chemotherapie, in der mehrere Medikamente zum Einsatz kommen. Sie zielt darauf ab, innerhalb kurzer Zeit die Mehrzahl der Leukämiezellen zu vernichten, das heißt, eine Remission herbeizuführen. Die Induktionstherapie dauert (ohne Vorphase) circa vier Wochen.
- Konsolidierung / Intensivierung: Die Konsolidierungs- oder Intensivierungstherapie ist ebenfalls eine intensive Chemotherapie, zum Teil mit anderen Medikamentenkombinationen und höheren Medikamentendosierungen. Ihr Ziel ist, die in der Induktionsphase erreichte Remission zu festigen ("konsolidieren"), das heißt, weitere Leukämiezellen zu vernichten und so das Risiko eines Krankheitsrückfalls zu verringern. Die Intensität der Behandlung richtet sich nach dem Rückfallrisiko des Patienten und kann entsprechend zwischen mehreren Wochen und Monaten dauern. Diese Therapiephase soll speziell auch das Zentralnervensystems und gegebenenfalls die Hoden erreichen (so genannte Extrakompartmenttherapie; siehe unten).
- ZNS-Therapie (Extrakompartmenttherapie): Ein wichtiger Bestandteil der gesamten intensiven Therapiephase, und in verstärktem Maße der Konsolidierung-/Intensivierungsphase, ist die Behandlung des Zentralnervensystems (ZNS). Die ZNS-Therapie ist äußerst wichtig, da bei den meisten Patienten das Zentralnervensystem befallen ist, selbst wenn keine Leukämiezellen nachweisbar sind. Da das Zentralnervensystem für viele Zytostatika schlecht zugänglich ist, erfolgt die Therapie mit bestimmten hochdosierten Medikamenten, die durch ihre besonderen Eigenschaften das Zentralnervensystem gut erreichen können. Außerdem werden immer wieder Zytostatika mittels Lumbalpunktion direkt in den Nervenwasserkanal gegeben (intrathekale Chemotherapie). Bei manchen (wenigen) Patienten kann zusätzlich eine Bestrahlung des Kopf-es in Frage kommen, zum Beispiel wenn das Zentralnervensystem nachweislich befallen ist oder eine T-ALL mit Hyperleukozytose vorliegt.
- Reinduktion: Bei ALL-Patienten hat sich eine weitere intensive Therapiephase ähnlich der Induktionstherapie, die Reinduktion, als erfolgreich erwiesen. Ihr Ziel ist, die Leukämiezellen vollständig zu zerstören und so das Risiko eines Krankheitsrückfalls zu minimieren. Die Reinduktionsphase kann zwischen mehreren Wochen und Monaten dauern, je nachdem, zu welcher Risikogruppe der Patient gehört. Bei längerer Therapiedauer (zum Beispiel bei Hochrisikopatienten) wechseln sich kurze intensive Behandlungsphasen mit milderen Chemotherapiephasen („Pausen“) ab, die der Erholung des Patienten dienen.
- Erhaltungs- oder Dauertherapie: Diese letzte Behandlungsphase ist darauf ausgerichtet, durch die möglichst lange Therapiedauer all jene Leukämiezellen zu vernichten, die trotz der intensiven Behandlung überlebt haben. Sie besteht aus einer milderen Chemotherapie und erfolgt vorwiegend ambulant; das heißt, der Patient kann während dieser Therapiephase wieder zu Hause sein und in der Regel auch den Kindergarten- oder Schulbesuch fortsetzen. Die Dauertherapie wird so lange durchgeführt, bis die vorgesehene Gesamt-Therapiedauer von zwei Jahren erreicht ist.
Zu den bei einer ALL eingesetzten Zytostatika gehören zum Beispiel Prednison (PRED) oder Dexamethason (DEXA), Vincristin (VCR), Daunorubicin (DNR), Asparaginase (ASP), Methotrexat (MTX), Cyclophosphamid (CPM), Cytarabin (ARA-C), 6-Mercaptopurin (MP), Etoposid und Thioguanin (TG).
Hinweis: Bitte beachten Sie, dass es – je nach Studie – gewisse Unterschiede bezüglich der Benennung der verschiedenen Therapiephasen und deren Dauer und Ablauf gibt. Im Rahmen von klinischen Studien können auch neue Therapieansätze (zum Beispiel eine Immuntherapie mit Antikörpern) in bestimmten Therapiephasen geprüft werden. Weitere Informationen zu möglichen Therapieabläufen finden Sie in der ausführlichen Patienteninformation im Kapitel "Ablauf der Chemotherapie".
Behandlungsmöglichkeiten bei Krankheitsrückfall
Im Falle eines Krankheitsrückfalles (Rezidiv) – er betrifft etwa 15 % der ALL-Patienten – stehen als Behandlungsmaßnahmen Chemotherapie, Strahlentherapie sowie die Stammzelltransplantation zur Verfügung. Bei der Mehrzahl der Patienten mit ALL-Rezidiv beinhaltet die Behandlung eine intensivierte Chemotherapie mit dem Ziel der Remission sowie, im Anschluss, eine allogene Stammzelltransplantation. Manche Patienten sind durch eine alleinige Chemotherapie heilbar. Eine Strahlentherapie kann zur Behandlung von Zentralnervensystem und/oder Hoden erfolgen. Patienten, die auf die konventionelle Therapie (Chemotherapie, Stammzelltransplantation) überhaupt nicht oder nur unzureichend ansprechen (refraktäres oder zweites ALL-Rezidiv), können möglicherweise von neuen Medikamenten mit anderen Wirkmechanismen profitieren, die im Rahmen von klinischen Studien getestet werden.
Therapieoptimierungsstudien und Register
Fast alle Kinder und Jugendlichen mit ALL werden in Deutschland im Rahmen von Therapieoptimierungsstudien behandelt. Es handelt sich dabei um kontrollierte klinische Studien, die das Ziel haben, erkrankte Patienten nach dem jeweils aktuellsten Wissensstand zu behandeln und gleichzeitig die Behandlungsmöglichkeiten zu verbessern und weiter zu entwickeln.
Patienten, die an keiner Studie teilnehmen, entweder weil zum Zeitpunkt ihrer Erkrankung keine Studie verfügbar ist oder weil sie die Einschlusskriterien einer bestehenden Studie nicht erfüllen, werden oft in einem so genannten Register dokumentiert. Die Behandlung erfolgt generell nach den Therapieempfehlungen der Studienzentrale. Auf diese Weise erhält der Patient die zu diesem Zeitpunkt verfügbare optimale Therapie.
Zurzeit gibt es in Deutschland, meist mit internationaler Beteiligung, die im Folgenden aufgeführten Therapiestudien und Register zur Behandlung von Kindern und Jugendlichen mit akuter lymphoblastischer Leukämie:
- Studie AIEOP-BFM ALL 2017: Internationale Therapieoptimierungsstudie für Kinder und Jugendliche mit ALL (Alter 0 bis 17 Jahre), die erstmalig an einer ALL erkrankt sind. Im Unterschied zur Vorläuferstudie (AIEOP-BFM ALL 2009) nimmt diese Studie auch Säuglinge im ersten Lebensjahr auf. An der Mitte 2018 eröffneten Studie beteiligen sich zahlreiche Kinderkliniken in ganz Deutschland sowie in weiteren europäischen Ländern und in Australien. Die Studie steht unter der Leitung von Prof. Dr. med. M. Schrappe (Universitätsklinikum Schleswig-Holstein, Campus Kiel).
- Studie ALLTogether1: Internationale Therapieoptimierungsstudie des neu gegründeten europäischen ALLTogether Konsortiums für Kinder, Jugendliche und Erwachsene (Alter: 0-45 Jahre) mit neu diagnostizierter ALL. Die weltweit größte Studiengruppe, an der auch die CoALL-Studienzentrale mit Sitz in Hamburg (Leitung PD Dr. med. Gabriele Escherich) beteiligt ist, prüft anhand zahlreicher Randomisierungs-Arme neue Therapiekonzepte der Therapieintensivierung bzw. -reduktion (in Abhängigkeit vom individuellen Rückfallrisiko der Patienten). Die ALLTogether1-Studie, die seit 01.04.2022 in Deutschland eröffnet ist, wird von M.D. PhD Mats Marshall Heyman (Karolinska University Hospital, Stockholm) geleitet. Die deutsche Studienleitung unter PD Dr. med. Gabriele Escherich (CoALL-Studienzentrale) befindet sich am Universitätsklinikum Hamburg-Eppendorf.
- Register CoALL 2020 (COALL steht für Cooperative ALL-Studie): Kinder und Jugendliche unter 18 Jahren (nach Rücksprache mit der Registerzentrale auch ab 18 Jahren), die nicht an der ALLTogether1-Studie teilnehmen, können in das Register der CoALL-Studienzentrale aufgenommen werden. Das Register erfasst seit Mai 2020 (als Übergangslösung nach Schließung der Studie COALL-08-09 für die Patientenaufnahme) Kinder und Jugendliche mit einer ALL jedweden Typs. Auch Patienten mit ALL als Zweitkrebserkrankung oder Rückfall sowie Patienten mit Non-Hodgkin-Lymphom werden eingeschlossen. Die Therapieempfehlungen im Rahmen des Registers orientieren sich an der Standardtherapie der ALLTogether-Studie. Die Leitung von Register und Studienzentrale hat PD Dr. med. Gabriele Escherich, Universitätsklinikum Hamburg-Eppendorf.
- Studie EsPhALL2017 / COGAALL1631: Internationale, multizentrische Therapieoptimierungsstudie zur Behandlung von Kindern und Jugendlichen (Alter: 1-21 Jahre) mit Philadelphia-Chromosom-positiver ALL. Die Studie ist in Deutschland seit 15.01.2019 für die Patientenaufnahme geöffnet. Zahlreiche kinderonkologische Zentren im In- und Ausland nehmen daran teil. Die für Deutschland zuständige Studienzentrale befindet sich am Universitätsklinikum Schleswig-Holstein (Campus Kiel) unter der Leitung von Prof. Dr. med. G. Cario.
- Register INTERFANT-06: Register für Säuglinge im ersten Lebensjahr mit akuter lymphoblastischer Leukämie oder biphänotypischer Leukämie (Untergruppe der ALL). Das Register setzt die seit Oktober 2016 für die Patientenaufnahme geschlossene Studie INTERFANT-06 mit entsprechender Behandlungsempfehlung fort. Aufgenommen werden Patienten, die nicht an der AIEOP-BFM ALL- oder der ALLTogether-Studie teilnehmen. Nationale Studienkoordination: Prof. Dr. med. M. Schrappe, Universitätsklinikum Schleswig-Holstein, Campus Kiel. Eine neue internationale Studie (INTERFANT 21) unter der Leitung von PD Dr. med. Gabriele Escherich (Universitätsklinikum Hamburg-Eppendorf) wird voraussichtlich im ersten Quartal des Jahres 2024 eröffnet.
- Register ALL SCT FORUM 2022: Nationales Register für ALL-Patienten (unter 21 Jahre alt) in Remission mit hohem oder sehr hohem Rezidivrisiko, für die eine allogene Stammzelltransplantation in Frage kommt. Das Interim-Register lst seit 13.09.2022 aktiv; es löst die in 2022 geschlossene Studie ALL SCTped 2012 FORUM bis zur Eröffnung einer Nachfolgestudie ab. Beteiligt sind Transplantationszentren in ganz Deutschland. Verantwortlicher Studienleiter ist Prof. Dr. med. Peter Bader an der Goethe-Universität, Frankfurt am Main.
- Studie IntReAll HR 2010: Internationale, multizentrische Therapieoptimierungsstudie für Kinder und Jugendliche (Alter: unter 18 Jahren) mit erstmaligem Rückfall einer ALL (B-Vorläufer- oder T-Zell-ALL, Hochrisiko-Patienten); an der Studie sind zahlreiche Behandlungseinrichtungen in ganz Deutschland sowie in vielen europäischen und außereuropäischen Ländern beteiligt. Die Studienzentrale befindet sich an der Klinik für Pädiatrische Onkologie und Hämatologie der Charité Berlin (Studienleitung: PD Dr. Arend von Stackelberg).
- ALL-REZ Beobachtungsstudie: In dieser Studie werden alle Rezidivpatienten erfasst, die nicht im Rahmen der oben genannten Studien behandelt werden. Dazu zählen beispielsweise Kinder und Jugendliche unter 18 Jahren, die an einem Zweitrezidiv erkranken. Leiter der Beobachtungsstudie ist PD Dr. Arend von Stackelberg (Klinik für Pädiatrische Onkologie und Hämatologie der Charité Berlin).
Hinweis: Die AIEOP-BFM-Studie und die (ehemalige) COALL-Studie beziehungsweise die entsprechenden Register sind für die gleiche Gruppe von Patienten konzipiert (ALL-Ersterkrankung, Alter: 0-17 beziehungsweise 1-17) und unterscheiden sich nur geringfügig. Die verschiedenen Behandlungszentren für Kinder und Jugendliche mit ALL sind jeweils auf eines der beiden Studienprotokolle (beziehungsweise die daraus hervorgehenden Empfehlungen) spezialisiert. Die CoALL-Studiengruppe beteiligt sich seit April 2022 als eine von insgesamt neun Studiengruppen an der neuen Phase-III-Studie des internationalen ALLTogether Konsortiums.
Bitte beachten Sie, dass Patienten mit reifer B-ALL (auch: B-AL) hier nicht berücksichtigt sind, da sie wie Patienten mit reifen B-Zell Non-Hodgkin-Lymphomen behandelt werden.
Das Hauptziel aller Studien ist, die Therapie von ALL-Patienten weiter zu verbessern und therapiebedingte Nebenwirkungen zu reduzieren. Darüber hinaus wird durch die intensive Therapie begleitende Forschung das Wissen über die Erkrankung vertieft. Die gewonnenen Erkenntnisse sollen in zukünftige Behandlungskonzepte einfließen.
Prognose
Die Heilungschancen (Prognose) von Kindern und Jugendlichen mit ALL haben sich dank der großen Therapiefortschritte in den letzten vier Jahrzehnten deutlich verbessert. Die heute eingesetzten modernen Untersuchungsmethoden und intensiven, standardisierten Kombinationschemotherapien führen dazu, dass insgesamt etwa 90 % der an ALL erkrankten Kinder und Jugendlichen dauerhaft von dieser Krankheit geheilt werden (10-15-Jahres-Überlebensraten). Damit gehört die ALL inzwischen zu den am besten behandelbaren Krebserkrankungen.
Im Falle ungünstiger Prognosefaktoren (zum Beispiel bei schlechtem Ansprechen der Erkrankung auf die Therapie oder schwer zu behandelnder ALL-Unterform) liegen die Heilungschancen, trotz intensivierter Behandlung, deutlich unter 90 %. Das gilt auch für Patienten, die unter einem Jahr oder über zehn Jahre alt sind.
Etwa 90 der jährlich ungefähr 550 bis 600 in Deutschland neu erkrankten Kindern und Jugendlichen mit ALL (das heißt, etwa jeder siebte Patient) erleiden einen Krankheitsrückfall (Rezidiv). Rezidive treten bei ALL-Patienten meist innerhalb der ersten zwei bis drei Jahre nach Diagnosestellung und nur noch sehr selten nach fünf Jahren auf. Die Heilungsaussichten sind generell wesentlicher ungünstiger als bei der Erstbehandlung, auch wenn bei einem Teil der Patienten durchaus noch gute Behandlungserfolge erzielt werden können. Die 5-Jahres-Überlebensraten liegen bei Kindern und Jugendlichen mit ALL-Rezidiv zwischen 50 und 60 %. Im Rahmen der derzeitigen Therapieoptimierungsstudien und zukünftiger Studien sollen die Heilungsaussichten auch für Patienten mit ungünstigerer Prognose weiter verbessert werden.
Anmerkung: Bei den genannten Heilungsraten handelt es sich um statistische Größen. Sie stellen nur für die Gesamtheit der an einer ALL erkrankten Patienten eine wichtige und zutreffende Aussage dar. Ob der einzelne Patient geheilt werden kann oder nicht, lässt sich aus der Statistik nicht vorhersagen. Eine Leukämieerkrankung kann selbst unter günstigsten beziehungsweise ungünstigsten Voraussetzungen ganz unerwartet verlaufen.
 PDF-Datei der Patienten-Kurzinformation zur akuten lymphoblastischen Leukämie (ALL) (287KB)
PDF-Datei der Patienten-Kurzinformation zur akuten lymphoblastischen Leukämie (ALL) (287KB)
Autor: Maria Yiallouros
Stand 30.11.2023
Literaturliste 
- Stanulla M, Erdmann F, Kratz CP: Risikofaktoren für Krebserkrankungen im Kindes- und Jugendalter. Monatsschrift Kinderheilkunde 169, 30-38 2021 [DOI: 10.1007/s00112-020-01083-8]
- Escherich G, Schrappe M, Creutzig U: Akute lymphoblastische Leukämie – ALL – im Kindesalter. AWMF online 2021 [URI: https://www.awmf.org/ uploads/ tx_szleitlinien/ 025-014l_S1_Akute-lymphoblastische-Leukaemie-ALL-im-Kindesalter_2021-07.pdf]
- Erdmann F, Kaatsch P, Grabow D, Spix C: German Childhood Cancer Registry - Annual Report 2019 (1980-2018). Institute of Medical Biostatistics, Epidemiology and Informatics (IMBEI) at the University Medical Center of the Johannes Gutenberg University Mainz 2020 [URI: https://www.kinderkrebsregister.de/ typo3temp/ secure_downloads/ 42507/ 0/ 1c5976c2ab8af5b6b388149df7182582a4cd6a39/ Buch_DKKR_Jahresbericht_2019_komplett.pdf]
- Schrappe M, Möricke A, Attarbaschi A, von Stackelberg A: Akute lymphoblastische Leukämie. in: Niemeyer C, Eggert A (Hrsg.): Pädiatrische Hämatologie und Onkologie. Springer-Verlag GmbH Deutschland, 2. vollständig überarbeitete Auflage 2018, 269 [ISBN: 978-3-662-43685-1]
- Tallen G, Henze G, von Stackelberg A: Treatment of children and adolescents with relapsed ALL: therapy target long-term healing. Pharm Unserer Zeit 2012, 41: 214 [PMID: 22844668]
- Möricke A, Zimmermann M, Reiter A, Henze G, Schrauder A, Gadner H, Ludwig WD, Ritter J, Harbott J, Mann G, Klingebiel T, Zintl F, Niemeyer C, Kremens B, Niggli F, Niethammer D, Welte K, Stanulla M, Odenwald E, Riehm H, Schrappe M: Long-term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the ALL-BFM study group from 1981 to 2000. Leukemia : 2010, 24: 265 [PMID: 20010625]
- Escherich G, Horstmann MA, Zimmermann M, Janka-Schaub GE, COALL study group: Cooperative study group for childhood acute lymphoblastic leukaemia (COALL): long-term results of trials 82,85,89,92 and 97. Leukemia : 2010, 24: 298 [PMID: 20016530]
- Schrappe M: Risk-adapted stratification and treatment of childhood acute lymphoblastic leukaemia. Radiation protection dosimetry 2008, 132: 130 [PMID: 19017727]
- Schrauder A, von Stackelberg A, Schrappe M, Cornish J, Peters C, ALL-BFM Study Group, EBMT PD WP, I-BFM Study Group: Allogeneic hematopoietic SCT in children with ALL: current concepts of ongoing prospective SCT trials. Bone marrow transplantation 2008, 41 Suppl 2:S71 [PMID: 18545248]
- Möricke A, Reiter A, Zimmermann M, Gadner H, Stanulla M, Dördelmann M, Löning L, Beier R, Ludwig WD, Ratei R, Harbott J, Boos J, Mann G, Niggli F, Feldges A, Henze G, Welte K, Beck JD, Klingebiel T, Niemeyer C, Zintl F, Bode U, Urban C, Wehinger H, Niethammer D, Riehm H, Schrappe M, German-Austrian-Swiss ALL-BFM Study Group: Risk-adjusted therapy of acute lymphoblastic leukemia can decrease treatment burden and improve survival: treatment results of 2169 unselected pediatric and adolescent patients enrolled in the trial ALL-BFM 95. Blood 2008, 111: 4477 [PMID: 18285545]